teste 1
A flor e o indicador
20 de março de 2014MATERIAIS E REAGENTES
MATERIAIS:
- 2 recipientes de plástico, cilíndricos e com tampa
- 1 flor artificial de tecido
- borrifador
REAGENTES:
- solução alcoólica de fenolftaleína (0,1%)
- solução de amônia 30% (encontrada em farmácias)
- bicarbonato de sódio
- ácido acético diluído (pode utilizar vinagre).
METODOLOGIA
1- No primeiro recipiente adicione aproximadamente 50 ml da solução de ácido acético diluído e 1g de bicarbonato de sódio.
2- No segundo recipiente adicione 20 gotas de solução de amônia. Tampe ambos os recipientes e aguarde alguns segundos.
3- Borrife as pétalas da flor com a solução de fenolftaleína.
4- Coloque a flor no recipiente contendo amônia, de modo que as pétalas fiquem em contato com o vapor da solução. Observe se há alteração na cor.
5- Coloque a flor no recipiente contendo bicarbonato de sódio, do mesmo modo que no passo anterior. Observe.
DISCUTINDO OS RESULTADOS
Quando a fenolftaleína, impregnada na flor, entra em contato com o vapor de amônia, ela adquire coloração rosa. Isso ocorre porque esse indicador é um ácido fraco e perde um próton quando em contato com uma base mais forte.
A flor rosada, ao entrar em contato com o vapor de dióxido de carbono, CO2, produzido na reação entre o ácido acético e o bicarbonato de sódio, perde a coloração, porque a espécie da fenolftaleína desprotonada (colorida) recupera o próton e retoma sua configuração anterior.
Quebrando Proteínas
10 de março de 2014MATERIAIS E REAGENTES
MATERIAIS:
- 4 tubos de ensaio numerados
- tampões de algodão
- pisseta
REAGENTES:
- suco de mamão
- suco de limão
- suco de abacaxi
- clara de um ovo cozido
- água
METODOLOGIA
1- Coloque água no tubo 1, suco de mamão no tubo 2, suco de limão no tubo 3 e suco de abacaxi no tubo 4.
2- Corte a clara de ovo em cubinhos iguais e coloque um em cada tubo.
3- Tampe com algodão e deixe em repouso por três dias.
COMENTÁRIO
Apenas no tubo 4 será possível perceber a diminuição da clara de ovo, já que a bromelina, enzima presente no abacaxi, provocou a quebra da proteína albumina.
No estômago e no intestino delgado as proteínas também são quebradas pelas enzimas.
A bromelina é uma enzima auxiliar na digestão de proteínas, pode também estimular os músculos das paredes intestinais
Voltando as atividades!
9 de março de 2014OXIRREDUÇÃO
9 de maio de 2013OBJETIVOS
- Compreender o que é oxidação e redução;
- Verificar as facilidades relativas com que as diferentes espécies químicas (átomos, íons, moléculas) sofrem oxidação ou redução.
INTRODUÇÃO
Algumas reações químicas ocorrem com transferência de elétrons de uma espécie química (átomos, íons, radicais) para outra. Uma espécie química atua doando e outra recebendo elétrons.
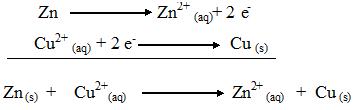
Seja a reação em meio aquoso entre o sal CuSO4 (aq) e o metal zinco Zn. O sulfato cúprico sal CuSO4 em água se dissocia dando íons cúpricos, Cu2+, que irão reagir com o metal zinco, de acordo com a seguinte equação:
Nesta reação, cada átomo de metal zinco perde dois elétrons para cada íon cúprico, que se transforma em cobre metálico (átomo neutro), enquanto o zinco se transforma em Zn2+(aq).
A perda de elétrons recebe o nome de oxidação e o ganho de elétrons, redução. Somando as duas semi-equações, tem-se como resultado a equação da reação total de oxirredução:
A explicação é que, no caso específico de metais, alguns têm maior tendência em existir na forma de metais (átomos neutros) e outros na forma de íons. No exemplo visto anteriormente, fica claro que o metal cobre tende a existir na forma de átomo neutro e o metal zinco, na forma de íon (mais e1etropositivo). Assim, o íon Cu2+(aq) remove do zinco metálico dois elétrons fracamente ligados, transformando o átomo de zinco em íon Zn2+(aq).
Deve também ficar claro que quanto maior o caráter metálico do elemento maior sua tendência de existir na forma de íons positivos e quanto menor seu caráter metálico maior sua tendência de existir na forma de átomos neutros (forma metálica). Essa maior ou menor tendência de existir na forma de íons ou de átomos neutros é a força motriz de reações de oxirredução envolvendo metais e íons metálicos.
Outro aspecto importante é que não pode ocorrer uma OXIDAÇÃO sem que ocorra simultaneamente uma REDUÇÃO. Na realidade, o metal que se oxida causa a redução do íon do outro metal, e este, por sua vez, causa a oxidação do primeiro. Assim, o metal que se oxida é o AGENTE REDUTOR e o íon que se reduz é o AGENTE OXIDANTE. No exemplo visto, o zinco metálico Zn (s) se oxida, portanto é agente redutor, enquanto o íon cúprico Cu2+(aq) se reduz, sendo o agente oxidante.
MATERIAIS E REAGENTES
MATERIAIS:
- Béquer de 100 mL
- Lixa ou esponja de aço
- Tubos de ensaio
REAGENTES:
- MgCl2 0,1 mol/L
- Pb(NO3)2 0,05 mol/L
- CuSO4 ou Cu(NO3)2 0,1 mol/L
- ZnSO4 0,1 mol/L
- FeSO4 0,1 mol/L
- Chumbo
- Cobre
- Ferro
- Magnésio
- Zinco
METODOLOGIA
1 – Prepare cinco tubos de ensaio colocando em cada um cerca de 5 mL de solução de Mg2+(aq). Para isto pode ser usada uma solução de MgC12 (aq) 0,1 mol/L. Coloque, respectivamente, em cada tubo um pedaço dos metais Mg, Zn, Fe, Pb e Cu. Deixe os tubos em repouso por alguns minutos. Em cada caso, observe se houve reação. Escreva as equações das reações que ocorreram.
2 – Lave os metais e repita a experiência usando em lugar da solução de Mg2+ (aq) uma solução de Zn2+ (aq) (por exemplo, ZnC12 (aq) 0,1 mol/L), Em cada caso, observe se houve reação e escreva as equações das reações que ocorreram.
3 – Lave novamente os metais e repita a experiência usando em lugar da solução de Zn2+ (aq) uma solução de Fe2+ (aq) (por exemplo, FeCl2 0,1 mol/L). Em cada caso, observe se houve reação e escreva as equações das reações que ocorreram.
4 – Repita a experiência, colocando cada metal em um tubo de ensaio que contém uma solução de Pb2+ (aq) (por exemplo, Pb(NO3)2 (aq) 0,1 mol/L). Em cada caso, observe se houve reação e escreva as equações das reações que ocorreram.
5 – Repita a experiência, colocando cada metal em um tubo de ensaio que contém uma solução de Cu2+ (aq) (por exemplo, Cu(NO3)2 (aq) 0,1 mol/L). Em cada caso, observe se houve reação e escreva as equações das reações que ocorreram.
6 – Reveja suas anotações em relação às perguntas referentes aos metais tratados nos procedimentos 1,2, 3, 4, e 5.
QUESTÕES DE VERIFICAÇÃO:
1) Que metal se oxida mais facilmente?
2) Que íon metálico se reduz mais facilmente?
3) Que metal não é oxidado por nenhum dos íons?
4) Que íon não é reduzido por nenhum dos metais?
5) Que espécie química (metal ou íon metálico) é o melhor agente oxidante e qual é o melhor agente redutor?
DETERMINAÇÃO DA ACIDEZ DO VINAGRE
9 de setembro de 2012OBJETIVO
Determinar a porcentagem (teor) de ácido acético no vinagre, realizando a titulação de um ácido fraco com uma base forte.
INTRODUCÃO
O vinagre, produto resultante da fermentação de certas bebidas alcoólicas, particularmente do vinho. Na fermentação do vinho, microorganismos da espécie Mycoderrna aceti transformam o álcool etílico em ácido acético. Após a fermentação, o vinho fica com cerca de 4 a 5% de ácido acético, recebendo então o nome “vinagre” (vinho azedo). O teor de CH3COOH no vinagre é determinado volumetricamente titulando-se certa quantidade de vinagre com uma solução padrão de hidróxido de sódio 0,100 N ou de normalidade próxima a 0,1 N, conhecida em três casas decimais. Usa-se uma solução de fenolftaleína como indicador, a de se ver o fim da reação.

MATERIAIS E REAGENTES
MATEIRAIS:
- Suporte universal
- Garra de bureta ou garra e mufa
- Béquer de 100 mL
- Funil
- Pisseta
- Bureta de 50 mL
- Proveta de 50 mL
- Proveta de 250 mL
- Erlenmeyer de 250 mL
- Pipeta graduada de 5 mL ou volumétrica de 2 mL
- Densímetro de 1,000 a 1,200 (optativo)
REAGENTES:
- Solução de fenolftaleína
- Vinagre
- Solução padrão de hidróxido de sódio, NaOH, 0,1 N
METODOLOGIA
1 – Coloque cerca de 230 mL de vinagre em uma proveta de 250 mL e, com um densímetro de 1,000 a 2,000, meça sua densidade.
d = ____ g/mL
2 – Pipete, com a técnica adequada, 2 mL de vinagre para um erlenmeyer de 250 mL.
3 – A esse vinagre, adicione mais ou menos 30 mL de água (medidos em uma proveta de 50 mL) e 5 a 10 gotas de fenolftaleína.
4 – Carregue corretamente uma bureta de 50 mL com a solução de NaOH, enchendo também a parte que fica abaixo da torneira.
5 – Gota a gota, acrescente essa solução de NaOH da bureta ao erlenmeye agitando-o constantemente, e feche a torneira da bureta logo que ocorrer a viragem do indicador. Anote o volume da solução de NaOH que foi gasto.
V1 = _____ mL
Com a viragem do indicador, a cor do líquido do erlenmeyer mudou de ____________________ para ____________________.
6 – Repita essa operação (passos 2, 3, 4 e 5) e anote a medição do volume da solução de NaOH.
V2 = _____ mL
Observação: Não pode haver muita diferença entre V1 e V2. Se houver, faça uma terceira titulação e despreze o valor discrepante.
7 – Calcule o volume médio de V1 e V2.  Vm = ______ mL
Vm = ______ mL
8 – Nesse processo, reagiram ácido acético e hidróxido de sódio, formando acetato de sódio e água.
9 – Os cálculos para a obtenção do teor de acidez no vinagre são fundamentados no fato de que, quando as substâncias reagem, o número de equivalentes de da reagente é igual ao número de equivalentes dos outros participantes da reação. Se reagiram nE equivalentes de NaOH, também reagiu o mesmo número nE de equivalentes de CH3COOH.
nE NaOH = nE CH3COOH = nE
10 – Já podemos fazer o cálculo do número de equivalentes de NaOH.
Vm = ______ mL = ______ L (do passo 7)
N = _______ (a Nr da solução de NaOH)
nE = VmN
nE = ___________
11 – Vamos agora ao cálculo da massa de ácido acético que reagiu. Sabemos número de equivalentes-grama do reagente CH3COOH (passo 10) e também o seu equivalente-grama.
nE = __________ (do passo 10)
E = 60 g
12 – Substituindo esses dados na fórmula:
nE =
m = nE .E
m = _____ g
Esse é o número de gramas de ácido acético contido no volume de 2 mL da amostra de vinagre.
13 – Para o cálculo do teor (massa) de ácido acético por litro de vinagre faremos uma regra de três (cada 2 mL de vinagre contêm m (passo 12) de ácido acético.
2 mL ———————– m
1.000 mL ———————– X
x = 500 m
x = ______ g
Isso quer dizer que a acidez do vinagre que utilizamos na experiência é ___ g/L.
14 – Obteremos a porcentagem de ácido acético em massa (gramas de ácido acético por 100 g de vinagre) utilizando a definição de densidade. Analisamos 2 mL de vinagre, cuja densidade foi obtida no passo 1:
V = 2 mL
d = _____ g/mL
15 – Substituindo esses dados na fórmula da densidade: 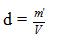
m’ = dV
m’ = _____ g
16 – Sabemos que m’ (passo 15) de vinagre contém m (passo 12) de ácido acético.
m’ ———————- m
100 g ——————– y
y = ______ %
Concluímos que a porcentagem em massa de CH3COOH no vinagre analisado é de ______%.
17 – Coloque os resultados no quadro abaixo:
QUESTÕES DE VERIFICACÃO:
1) Como é obtido o vinagre?
2) Por que o vinagre é ácido?
3) O vinagre é uma substância ou uma mistura? Por quê?
4) Qual é a cor da fenolftaleína em meio ácido? E em meio básico?
5) Para que foi usada a fenolftaleína nessa análise?
6) Por que se adicionou cerca de 30 mL de água destilada antes da titulação?
7) Esse volume de água precisa ser medido com exatidão? Por quê?
8) Se uma pessoa ingere 50 mL de vinagre numa salada, quantos gramas de ácido acético a pessoa ingeriu? (Considere: densidade do vinagre = 1,1 g/mL; teor CH3COOH = 5% em massa.)
9) O processo que você utilizou nesta aula pode ser utilizado em uma fábrica vinagre para se obter a acidez do vinagre que produz?
10) Com base nos resultados obtidos por você nessa aula prática, diga o que acha de um vinagre com 20% ou 30% de ácido acético.
Segurança Laboratorial
28 de março de 2012O laboratório é um recinto construído especialmente para a execução de experiências. Ele é definido como uma dependência adaptada para o trabalho prático. No entanto, apesar de reconhecida à necessidade de laboratório, muitas escolas foram construídas sem se prever tal dependência.
Para evitar acidentes, ao entrar em um laboratório, ao aluno deve ser colocada a necessidade da observância de normas e procedimentos para sua segurança e de seus colegas. Por isso, algumas regras mínimas de comportamento devem ser adotadas:
a) Ter sempre presente que o laboratório é um lugar de trabalho sério; conseqüentemente, toda e qualquer brincadeira é expressamente proibida;
b) Realize somente as experiências discutidas com o professor e com os colegas;
c) Para sentir o cheiro de uma substância, não coloque o rosto diretamente sobre o frasco que a contém; abane com a mão por cima do frasco aberto e desloque, na sua direção, uma pequena quantidade de vapor para cheirar;
d) Dar tempo suficiente para que um vidro quente se arrefeça, coloque-o sobre uma tela de amianto, pois isto pode ser considerada uma indicação de que o material está aquecido, lembre-se que um vidro quente tem a mesma aparência de um vidro frio;
e) Basicamente todos os produtos químicos são tóxicos, portanto evite contato ou exposição desnecessária;
f) Verifique cuidadosamente o rótulo do frasco que contém um dado reagente, antes de tirar dele qualquer porção;
g) As porções de reagentes que não forem usadas nunca devem voltar para o frasco de onde foram retiradas; nunca se deve introduzir qualquer objeto no frasco de um reagente, exceção feita para o conta-gotas com o qual ele possa estar equipado;
h) Nunca pipete produto químico com a boca, para isso existem pêras de borracha, pipetas automáticas e seringas descartáveis;
i) Trabalhe sempre com avental abotoado, comprido, de mangas longas e de algodão na cor branca;
j) Acostume-se a usar, no laboratório, um calçado simples, fechado de couro ou similar, de salto baixo e sola pouco escorregadia ou antiderrapante;
k) Óculos de segurança são altamente recomendados no laboratório, especialmente onde seu uso é obrigatório; sempre que houver riscos potenciais, use e faça com que as demais pessoas os usem;
l) Nunca leve as mãos aos olhos e à boca, quando estiver no laboratório, pois suas mãos poderão estar contaminadas e poderá haver danos perceptíveis e imperceptíveis;
m) É vedada a colocação de qualquer tipo de alimento sobre as bancadas, em armários e em geladeiras de laboratórios;
n) Feche todas as gavetas e portas dos armários que abrir;
o) Mantenha as bancadas sempre limpas e livres de materiais estranhos e não pertencentes ao trabalho a ser desenvolvido;
p) Rotule imediatamente qualquer reagente ou solução preparada e amostras coletadas;
q) Nunca realize tarefa de risco sentado, pois desta forma os movimentos focam tolhidos;
r) Em caso de dúvida quanto a toxicidade do produto, consulte o orientador dos trabalhos e/ou proceda como se fosse de máxima toxicidade no seu manuseio;
s) Trabalhe com produtos voláteis somente na capela;
t) Não jogue produtos tóxicos na pia;
u) Ao sentir qualquer sintoma de mal-estar, interrompa o trabalho imediatamente e avise seu orientador/professor e, acompanhado dirija-se então ao socorro médico, com a ficha do produto manuseado.
Cabe ao professor lembrar, no início de cada atividade, as regras de segurança necessárias, lembrando sempre a importância de seu cumprimento, além de discutir previamente com seu grupo de alunos, destacando os riscos e os procedimentos seguros para a realização da atividade prática.
OBTENDO O GÁS METANO
9 de junho de 2011MATERIAIS E REAGENTES
MATERIAIS:
- 1 tubo de ensaio
- 2 vidros de relógio
- 1 rolha de borracha tubo de ensaio com orifício
- 1 rolha com dois orifícios para o erlenmeyer
- 1 tubo de vidro curvado em 30° que caiba no orifício da rolha do tubo e do erlenmeyer
- 1 tubo de vidro curvado em 45° com ponta afilada que caiba na rolha do erlenmeyer
- 1 almofariz com pistilo
- 1 suporte universal com garras
- 1 bico de bunsen
- Fósforos de segurança
REAGENTES:
- Óxido de cálcio (CaO)
- Hidróxido de sódio (NaOH)
- Acetato de sódio (CH3COONa)
METODOLOGIA
1 – Reserve 1,0 g de óxido de cálcio e 1,0 g de hidróxido de sódio.
2 – Misture os dois compostos reservados; com esse procedimento, você estará produzindo a cal sodada.
3 – Adicione 2,0 g de acetato de sódio anidro e 2,0g da cal sodada no almofariz e, utilizando o pistilo, homogeneíze bem a mistura.
4 – Coloque o produto obtido no tubo de ensaio e fixe-o no suporte universal num ângulo de 30° em relação à superfície da bancada.
5 – Fixe o erlenmeyer no suporte universal de modo que as rolhas dos dois recipientes possam ser fixadas com precisão.
6 – Submeta o tubo de ensaio ao aquecimento em fogo baixo por 5 minutos.
7 – Decorrido esse tempo, nem um minuto a menos, acenda a extremidade livre do tubo de vidro que sai do erlenmeyer e observe.
Observação: Não coloque fogo na saída do erlenmeyer antes dos 5 minutos.
QUESTÃO DE VERIFICAÇÃO:
1) Por que o fogo não pode ser ateado antes dos 5 minutos de aquecimento?
PREPARANDO UM POLÍMERO
9 de abril de 2011MATERIAIS E REAGENTES
MATERIAIS:
- 2 béqueres de 250 mL
- 1 vidro de relógio
- 1 pipeta de 5 mL
- 1 bastão de vidro
- 1 conta-gotas
- 1 espátula
- 1 balança de 0,1 g ou 0,01 g
- 1 pedaço de 15 cm x 15 cm de filme de PVC
REAGENTES:
- Formol
- Uréia
- Ácido clorídrico concentrado
METODOLOGIA
1- Reserve uma alíquota de 3,0 g de uréia em um vidro de relógio e transfira-a para um béquer.
2- Coloque, lentamente, 5 mL de formol no mesmo béquer e homogeneíze o conteúdo com um bastão de vidro.
3- Umidifique o outro béquer e coloque o filme de PVC, de modo que a região central fique dentro do frasco e as bordas do plástico pendam para fora do recipiente.
4- Transfira a solução preparada para o béquer revestido interiormente pelo filme e adicione gota a gota o ácido clorídrico concentrado à solução de uréia em formol, mantendo-a em constante movimentação.
5- Interrompa o processo quando a reação produzir uma massa viscosa e de aspecto perolado.
6- Remova o filme de PVC e o produto obtido de dentro do béquer e transfira-o para o vidro de relógio. Aguarde por 60 minutos e, com o auxílio do bastão de vidro, verifique a consistência do produto.
7- Enxágüe o produto sem colocar as mãos no material formado e observe-o.
8- Mantenha o material obtido no vidro de relógio e aguarde.
QUESTÕES DE VERIFICAÇÃO:
1) Que tipo de polímero foi formado?
2) Qual o nome desse polímero?
3) Por que se usou um filme de PVC para revestir o béquer?
4) O que justificaria a necessidade de se esperar uma hora para que se verificasse a consistência do produto?
5) Qual o aspecto do produto ao final do experimento?
Resíduos e Rejeitos Laboratorias
28 de março de 2010Uma aula experimental de Química, por gerar produtos perigosos, é uma atividade potencialmente poluidora. Para diminuir esse problema, durante seu planejamento, deve-se avaliar e reconhecer os riscos e os perigos dos produtos químicos que serão manuseados, bem como dos resíduos ou rejeitos produzidos durante esta.
Tanto os resíduos quanto os rejeitos “são materiais remanescentes de alguma apropriação, processo ou atividade desenvolvida” (FIGUERÊDO, 2006)
De acordo com Amaral et al. (2001), a diferença entre eles é que o resíduo possui um potencial de uso com ou sem tratamento. Já o rejeito não apresenta possibilidade técnica ou econômica de uso, devendo ser tratado para descarte final.
Minimizando a produção de resíduos
Para eliminar de forma adequada os resíduos de laboratório são necessários pelo menos, algum conhecimento do tipo de produto ou subproduto a ser eliminado. A partir disto, sabendo algumas características químicas do resíduo, pode-se acondicioná-lo em recipientes adequados e descartá-lo de forma segura.
Para a minimização de material residual, segundo Machado e Mól (2008), o professor deverá seguir alguns critérios de utilização racional, segura e ambientalmente adequada de produtos químicos. A teoria dos 4 Rs (Reduzir, Reusar, Reciclar e Recuperar) insere-se perfeitamente nessa proposta para trabalhar Educação Ambiental em aulas de Química. Para minimizar a produção de resíduos químicos, é recomendável:
a) Reduzir fontes geradoras de poluição, diminuindo volumes e concentrações de reagentes químicos;
b) Utilizar reagentes que causem menor impacto ambiental, incluindo a saúde dos indivíduos;
c) Reusar, recuperar e reciclar, sempre que possível, os resíduos químicos, preservando recursos naturais;
d) Planejar a aquisição de produtos químicos em pequenas quantidades, evitando deterioração e acúmulo destes no laboratório, visto que o acúmulo de materiais aumenta os riscos de derramamentos e incêndios;
e) Controlar o estoque de produtos químicos por meio de inventário, suas condições de armazenagem e a integridade de seus rótulos;
f) Evitar a obtenção e o uso de substâncias de elevada toxicidade como, por exemplo, benzeno, tolueno, clorofórmio, formaldeído, tetracloreto de carbono ou sais contendo íons de mercúrio, chumbo, cromo, cádmio, níquel, bário, arsênio, ósmio, cianetos etc.;
g) Não aceitar doações de produtos químicos que não estejam nos planos de utilização e que possam se transformar em resíduos;
h) Doar ou trocar com outras instituições produtos químicos excedentes ou que não estejam mais em uso no laboratório, antes que estes se tornem instáveis, reativos ou até explosivos;
i) Alterar experimentos que não se enquadrem nessa proposta, substituindo reagentes químicos sem prejudicar a compreensão das relações conceituais exploradas.
Produção de Rejeitos
Mesmo seguindo essas recomendações, no laboratório de ensino, sempre há produção de rejeitos que necessitam ser tratados para disposição final. Nesse caso, segundo Machado e Mól (2008), faz-se necessário observar os seguintes procedimentos:
a) Não misturar materiais perigosos com não perigosos (por exemplo: soluções aquosas com resíduos orgânicos, soluções contendo metais tóxicos com aquelas que não os contêm), já que terão destinos diferenciados;
b) Não misturar solventes orgânicos não halogenados com halogenados, visto que poderão ser tratados de formas distintas;
c) Respeitar a incompatibilidade entre resíduos perigosos para não os acondicionar em um mesmo recipiente;
d) Coletar os resíduos em recipientes limpos, compatíveis, em bom estado e com tampas ajustadas adequadamente;
e) Rotular os recipientes conforme seus conteúdos e riscos. Cada rótulo deve indicar claramente: a composição química aproximada, os nomes das substâncias contidas, suas concentrações, seus riscos físicos e para a saúde, a procedência, o nome do responsável pelo laboratório e a data de coleta;
f) Armazenar corretamente os recipientes até o descarte, respeitando possíveis incompatibilidades entre seus conteúdos;
g) Não preencher os recipientes além de 2/3 de suas capacidades, devido à possibilidade de geração de gases, o que acarretaria riscos de derramamento do material;
h) Ao utilizar sacos plásticos como recipientes primários, usar outro recipiente rígido, como plástico ou caixa de papelão, para embalar;
i) Redobrar os cuidados com a segurança dos indivíduos que manuseiam resíduos/rejeitos, utilizando os equipamentos de proteção individual e coletiva imprescindíveis à atividade.
Portanto, caberá ao professor buscar formas de minimizar a quantidade dos resíduos gerados nas aulas experimentais, bem como planejar a recuperação ou o descarte deles. Além disso, é importante que ele debata com seus alunos sobre a necessidade de se dispor corretamente rejeitos perigosos conforme.